Als een substraat en een katalysator elkaar tegenkomen gaan ze een interactie aan en start de reactie. Het is een kansspel, komen de beide moleculen elkaar niet tegen dan vindt er geen reactie plaats. Bij polymeerreacties of enzymatisch gekatalyseerde reacties is de concentratie van reactanten vaak laag, met een lage reactiesnelheid tot gevolg.
Een oplossing lijkt simpel: zorg dat de katalysator aan het polymeer blijft zitten gedurende meerdere omzettingen. Als deze manier van katalyse bedrijven echt van de grond komt denk ik dat je in de polymeerchemie factoren efficiënter kan werken, zegt postdoc Stijn van Dongen die de Nijmeegse katalysator mede ontwikkelde en analyseerde.
Perfect natuurlijk systeem
Zoals zo vaak heeft de natuur dit kunstje, dat processieve katalyse heet, al geperfectioneerd. Een processieve katalysator bindt aan het substraat en doorloopt meerdere katalytische cycli voordat het complex van katalysator en substraat weer dissociëert. Processieve katalyse is daarom in de kern veel efficiënter dan 'gewone', zogeheten distributieve katalyse. Maar zelf een goed werkend systeem maken blijkt niet eenvoudig.
In 2003 demonstreerde de Nijmeegse onderzoeksgroep van hoogleraar Roeland Nolte voor het eerst de werking van een synthetische processieve katalysator. Een rotaxaan (een molecuul met een holte, ontwikkeld en gesynthetiseerd in de groep) onder andere bestaand uit een mangaanporfyrine, schuift over een polybutadiëenketen en oxideert in het voorbijgaan de dubbele bindingen.
De Japanse onderzoeker Akira Harada slaagde er in 2011 in om een polymeer te rijgen van monomeren van d-valerolacton, met hulp van een dimeer van cyclodextrine, grote ringvormige suikers. Het zich vormende polymeer steekt door een van de ringen, terwijl het volgende monomeer dat wordt gekoppeld in de tweede ring bindt en zo op z'n plaats wordt gehouden voor de reactie. De Japanners noemden dit een voorbeeld van een synthetische polymerase. 'Net als wij maakt Harada niet-processieve systemen processief door gebruik te maken van ringen,' legt Van Dongen uit.
Eerste resultaat
Het plan van Nolte om dit onderzoeksgebied een nieuwe impuls te geven werd beloond met een prestigieuze ERC Advanced Grant. Een eerste resultaat is de katalysator die DNA knipt.
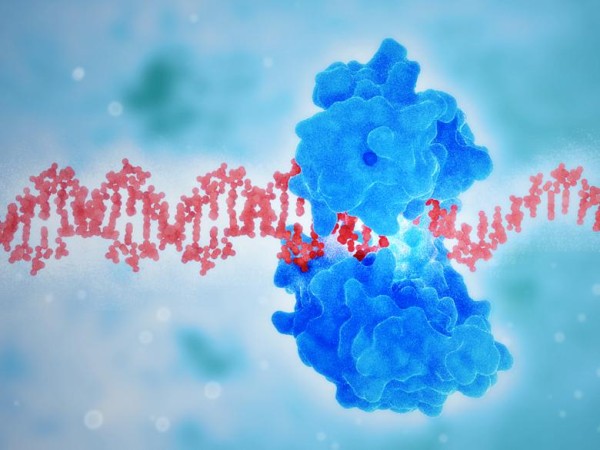
Daartoe leenden Nolte, Van Dongen en collega's een C-vormig eiwit genaamd gp45 (in rood) uit het DNA-gereedschapskist van een T4 bacteriofaag, waarin het zorgt dat DNA-polymerase aan de keten bindt. Het eiwit omklemt de dubbele helix van het DNA. Aan het eiwit maakten ze drie mangaanporfyrines vast. Dat zijn schijfvormige moleculen die oxidatiereacties katalyseren. Het gemodificeerde eiwit bindt aan een DNA plasmide en beweegt eroverheen.
De porfyrines hebben de neiging tussen de basenparen in te schuiven (intercaleren). Dat lukt alleen maar in een stukje DNA met de sequentie AAA aan een kant, legt Stijn van Dongen uit. Een C-G paar heeft een te sterke binding en wanneer er minder zijn dan drie A's naast elkaar is de ruimte te klein. Van Dongen: Dit vind ik een van de leukste dingen van het project. Er bestaat dus een simpele porfyrinekatalysator, die toch specifieke sequenties herkent op het DNA. Wanneer de porfyrine op zo'n AAA-plaats intercaleert, oxideert de ruggengraat van het DNA (het deoxyriboseskelet) tot een aldehyde en breekt er een zijde van de dubbele DNA-keten af en vormt zich een zogeheten nick.
Clusters
De onderzoekers toonden aan dat het gemodificeerde enzym inderdaad bindt aan een DNA-keten door te laten zien dat de oxidatiereacties in clusters plaatsvinden en niet willekeurig verspreid over de keten. Na de oxidatiereactie laat het enzym dus niet los, maar schuift het geheel over de keten naar een nieuwe AAA-plaats en vindt er weer een oxidatie plaats.
Het bewijs hiervoor is met een atoomkrachtmicroscoop (AFM) geleverd. De onderzoekers brachten de plaatsen op het DNA in beeld waar de keten is geoxideerd. De AFM meet minuscule hoogteverschillen op een oppervlak. Om zo'n hoogteverschil in het DNA te creëren verbonden de onderzoekers een groot eiwit, streptavidine, aan de plaatsen waar de oxidatie heeft plaatsgevonden. Die plaatsen zijn ruim 4 nm hoog, terwijl de intacte dubbele helix van het DNA slechts 1,2 nm hoog is. De verkregen AFM-beelden laten duidelijk zien dat de geoxideerde plaatsen in groepjes voorkomen op de keten.
Fundamenteel
Hoewel het systeem werkt, staan er nog talloze onderzoeksvragen open. De efficiëntie van de reactie is nog lang niet zo hoog als bij het repliceren van DNA. De katalysator oxideert ook niet alle AAA-sites maar slaat er wel eens een over. Andere dan oxidatiereacties zijn nog niet getest. Een van de volgende stappen is om een synthetisch polymeer te oxideren in plaats van DNA. De bestaande klem bindt niet zomaar om een willekeurig polymeer, zoals polybutadiëen, polyethyleenglycol, polyethyleenimine of polyisocyanide. Er wordt nu gezocht naar modificaties van deze polymeren die wel werken.
Nolte: Dit is gewoon interessant fundamenteel onderzoek. Het is compleet nieuw dus we leren van alles wat we doen. Er zijn bijvoorbeeld polymeren met dubbele bindingen in de hoofd- en de zijketen die selectief gehydrogeneerd of geoxideerd moeten worden. Met een processieve katalysator kun je mogelijk sturen welke dubbele bindingen je wilt laten reageren.'
Hoe werkt DNA polymerase?
Een DNA polymerase zoals die van het T4 bacteriofaag bestaat vaak uit een klem die het complex op z'n plaats houdt en een katalytisch actief deel. De klem van de T4 bacteriofaag polymerase bestaat uit een trimeer van L-vormige identieke eiwitten in een C-vorm. Een derde onderdeel is de clamp loader die de klem helpt om aan de keten te binden. Tijdens de DNA replicatie schuift de klem over de DNA-keten. De clamp loader bepaalt waar het polymerase aan het DNA bindt, bijvoorbeeld waar schade is die gerepareerd moet worden of waar het DNA enkelstrengs is. Het enzym, dat in oplossing zit, heeft een peptidestaart die bindt in de opening van de C-vormige klem zodat die zich sluit. Op dat moment kan het complex niet meer van de DNA-keten af en kan het enzym zijn werk doen. Het geheel schuift stapje voor stapje over de keten. De dubbele helix wordt eerst gesplitst in enkele strengen. Ieder van die strengen wordt door het aanrijgen van nieuwe basen weer een dubbele zodat er twee identieke DNA dubbele helices ontstaan.
Dit artikel is gepubliceerd in C2W 3 - 21 februari 2014