Antigenen op een presenteerblaadje
Bastienne Wentzel
28 februari 2006, Conceptuur
Mensen met een goed werkend afweersysteem ontwikkelen minder snel tumoren dan mensen met een verzwakte afweer. Ongeneeslijk ziek verklaarde kankerpatiënten genezen soms wonderbaarlijk na een stevige infectie als gevolg van het afweersysteem. Hieruit moge blijken dat het afweersysteem ook in werking is bij tumoren. Tumorafweer bestaat dus wel degelijk. De stimulering van het immuunsysteem om op te treden tegen tumoren is een belangrijke stap richting een vaccin tegen kanker. Dendritische cellen spelen een grote rol bij deze therapie.
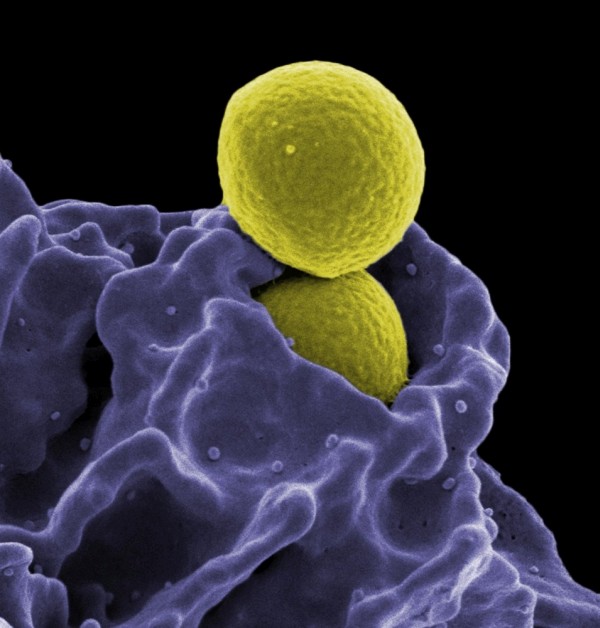
De eerste klinische studie van een vaccin op basis van dendritische cellen (DCs) tegen een tumor werd gepubliceerd in 1996. Sindsdien is onomstotelijk vastgesteld dat dendritische cellen een immuunrespons op kunnen wekken bij sommige kankerpatiënten. Deze cellen met veel vertakkingen (het Griekse dendron betekent boom) bezitten de capaciteit om antigenen op te nemen en te verwerken tot kleine stukken eiwitten. Vervolgens migreren ze naar de lymfeknopen om het antigeen daar te presenteren aan lymfocyten (T-cellen) in ruste. Ze worden daarom ook wel antigeen presenterende cellen (APC) genoemd.
Kruispunt
Het immuunsysteem bestaat uit verschillende onderdelen die samenwerken om ongewenste indringers te vernietigen. De eerste verdedigingslinie wordt gevormd door onder andere natural killer cells (NK-cellen) die bijvoorbeeld virus-geïnfecteerde cellen doden. Deze reacties zijn niet-specifiek en vallen onder de aangeboren immuniteit. De tweede lijn is de verworven immuniteit en heeft een geheugen waardoor de respons op een pathogeen steeds beter wordt. Deze linie bestaat uit T- en B-cellen die een pathogeen heel specifiek herkennen. Voor elke ziekteverwekker wordt een aparte set van cellen actief, die alleen reageert op die specifieke indringer.
Dendritische cellen opereren op het kruispunt van de aangeboren en de verworven immuniteit. Ze bevinden zich in weefsels die een barrière vormen tussen het lichaam en de buitenwereld, zoals de huid, de longen en de darmen. De hoofdtaak van DCs bij een infectie is het activeren van naïeve T-cellen die nog niet eerder met pathogenen in aanraking zijn geweest.
DCs komen via het bloed in alle delen van het lichaam (weefsel en organen) en speuren daar naar vreemde indringers. Ze nemen ter plekke antigenen op en knippen deze vervolgens in kleine stukken peptide die ze presenteren op hun celoppervlak. Dit wordt het laden van de DCs genoemd. Vervolgens veranderen de DCs van vorm en samenstelling zodat ze beter migreren naar de lymfeklieren en in staat zijn de antigenen door te geven, het zogenaamde matureren. In de lymfeklieren geven ze de specifieke eigenschappen van de gevonden vreemdelingen door aan de B-cellen en T-cellen. Deze zorgen op hun beurt weer voor een afweer op maat, waarbij ze zich ontwikkelen tot plasmacellen en T-killer cellen.
Dendritische immunotherapie
Normaal gesproken reageert het afweersysteem niet op lichaamseigen eiwitten. Een DC of een T-cel kan bijvoorbeeld een tumorcel wel herkennen omdat er andere eiwitten op de celwand zitten dan de lichaamseigen, maar alleen als beide goed geactiveerd worden komt er een effectieve afweerreactie opgang. Dat is meestal niet het geval. T-cellen reageren dan nauwelijks op de tumor. Een potentieel middel om tumoren aan te pakken is het stimuleren van T-cellen door te zorgen dat meer goed geactiveerde DCs hun werk doen.
Al enkele jaren vindt in de vakgroep tumorimmunologie waar prof. dr. Gosse Adema (Nijmegen Center for Molecular Life Sciences, UMC St Radboud) werkt intensief onderzoek plaats op het gebied van dendritische cel vaccinatie (DC-vaccinatie). Het principe van vaccinatie is eenvoudig. Dendritische cellen worden geïsoleerd uit het bloed van een patiënt door het verzamelen van witte bloedcellen in een celscheider. De voorloper DC-cellen worden ex vivo gezuiverd en gekweekt in het laboratorium. Vervolgens worden de DCs gerijpt en geladen met voor de kankercellen specifieke doeleiwitten, de antigenen. Daarna wordt het vaccin met antigenen aan de patiënt toegediend. Na het terugbrengen in het lichaam stimuleren deze DCs veel grotere hoeveelheden killer T-cellen dan voor de behandeling waardoor de tumor geheel of gedeeltijk wordt opgeruimd.
Onderzoek richt zich in belangrijke mate op optimalisatie van de bereiding van DCs en het tot expressie brengen van de tumorantigenen. In het Nijmeegse onderzoek werken meerdere afdelingen samen en zijn inmiddels tientallen patiënten met stadium IV melanoom behandeld. De DC-vaccinatie blijkt in een aantal van deze patiënten een immuunrespons op te wekken met een positief effect op de laesie.
Migratie volgen
De ex vivo gekweekte DCs worden in de lymfeklier of in de huid toegediend aan de patiënt. Het is de bedoeling dat de DCs vervolgens migreren naar de T-cellen om hun werk te doen. Dit migreren blijkt niet altijd effectief te verlopen. Om dat probleem op te lossen is het van cruciaal belang om precies te volgen waar de DC-cellen zich in het lichaam bevinden. In Nijmegen is daarvoor een MRI-methode ontwikkeld waarbij via een MRI-scan de DCs nauwkeurig zijn te volgen. De onderzoekers labelden daarvoor de DCs met kleine ijzerdeeltjes. Deze DCs injecteerden zij in de patiënt. Vervolgens konden zij op de MRI scan exact volgen waar de DCs zijn.
Uit onderzoek is duidelijk gebleken dat alleen gerijpte DCs in staat zijn de T-cellen te activeren. Een mogelijke verklaring is dat alleen gerijpte cellen in de lymfeklieren terechtkomen, de plek waar T-lymfocyten moeten worden geactiveerd door de antigenen op de gerijpte dendritische cellen. Onrijpe DCs kunnen zelfs het omgekeerde doen: tolerantie opwekken voor antigenen. Voor een immunotherapie tegen kanker is dat uiteraard niet wenselijk. Deze eigenschap van onrijpe DCs kan echter wel ingezet worden voor de behandeling van afstotingsverschijnselen bij transplantatie, bij allergie, autoimmuunziekten of chronische infecties.
Standaardisatie
Het rijpen (matureren) van de DCs is van veel factoren afhankelijk en het is belangrijk die factoren zo constant mogelijk te houden. Omdat een vaccin wordt gemaakt van de eigen cellen van een patiënt is het vaccin verschillend en uniek voor iedere patient. De Nijmeegse onderzoekers hebben daarom een protocol ontwikkeld om de bereiding van een vaccin zoveel mogelijk te standaardiseren zodat uitkomsten van onderzoek met elkaar vergeleken kunnen worden. Deze methode wordt nu ook door andere groepen overgenomen.
Ondanks goede resultaten heeft de ex vivo productie ook nadelen, met name is het tijdrovend en arbeidsintensief. Zeer welkom is een alternatieve aanpak waarbij DCs in vivo worden geladen en gerijpt om uiteindelijk tumorvaccins te ontwikkelen. Daarmee wordt de optimalisatie van de complexe mechanismen die het proces van rijping en migratie bepalen aan het lichaam zelf overgelaten. Verwacht wordt dat in vivo gegenereerde vaccins breder toepasbaar zullen zijn dan ex vivo vaccins. Een nadeel is dat de ontwikkeling van de DCs in vivo ook negatief beïnvloed kan worden bijvoorbeeld de aanwezigheid van stoffen die de tumor aanmaakt om het afweersysteem te onderdrukken. Het is mogelijk dat de maturatie slechter verloopt en daardoor de effectiviteit van de DCs afneemt.
De veiligheid van DC immunotherapie is inmiddels wel bewezen en studies bij muizen en kleinschalig onderzoek bij terminale kankerpatiënten laten zien dat DC vaccins effectief kunnen zijn. Echter meer onderzoek is nodig om de DC vaccins te verbeteren zodat meer patienten genezen. Onderzoek bij patiënten met kanker in een minder vergevorderd stadium kost meer tijd omdat de ontwikkeling van tumoren langzamer gaat. Onderzoekers verwachten dat ex vivo en in vivo methodes naast elkaar ontwikkeld zullen worden. Veel kennis met betrekking tot de rol van diverse stimulatoren voor maturatie en migratie van DCs ontbreekt nog. Ook zijn grootschalige klinische dubbel-blind studies nog beperkt uitgevoerd. Wanneer DC immunotherapie op grote schaal beschikbaar. zal zijn is lastig precies te voorspellen maar zal zeker nog wel een aantal jaren duren.
Opwekken van een anti-tumor respons
[Vrij naar Adema et al, Expert Rev Vaccines 4 (5), 2005, Fig 2 p705]
De eerste belangrijke stap in het immunisatieproces is het laden van de DCs met antigenen. Een onrijpe DC (A) is goed in het opnemen van alles wat in de omgeving komt, bijvoorbeeld antigenen. Voor de activering van T-cellen is het noodzakelijk dat de DC rijpt tot een geactiveerde, gematureerde DC. Deze rijping, de tweede stap in het proces vindt plaats in reactie op een infectie (B). Kenmerken van gematureerde DCs zijn onder andere de dunne en langwerpige uitstulpingen en de aanwezigheid van grote hoeveelheden MHC eiwitten. Het presenteren van antigenen aan T-cellen wordt door beide vergemakkelijkt.
Maturatie is een complex proces waarvan het resultaat afhankelijk is van signalen die de DC krijgt. De signalen komen van zogenaamde pathogen-associated molecular patterns (PAMPs) of van moleculen die vrijkomen na beschadiging van weefsel, bijvoorbeeld cytokinen. Van beide is bekend dat ze de DC activeren die op hun beurt de immuunrespons van T-cellen vergroten. Afhankelijk van de signalen worden dus geselecteerde tumorantigenen (speciale eiwitten in de tumorcellen) tot expressie gebracht.
Het derde essentiële proces in de levenscyclus van DCs is de migratie (C) van de plek waar zij antigenen opnemen naar de lymfeklieren waar T-cellen worden geactiveerd (D). De coördinatie van deze reis is in handen van chemokinen, hun receptoren, matrix moleculen en adhesion moleculen. Ook weefsel speelt een belangrijke rol.
Subsidies
De afdeling Tumorimmunologie van het NCMLS in Nijmegen is eind 2005 rijk bedeeld met subsidies van onder andere NWO. Prof. Dr. Gosse Adema kreeg een Vici beurs. Met deze beurs wil Adema tot cel- en molecuulniveau inzoomen op de precieze werking van de dendritische cellen in het immuunsysteem, die twee kanten op kan gaan, richting tolerantie of richting afweer. Adema en zijn onderzoeksgroep vonden al eerder twee nieuwe eiwitten, DCSTAMP en DCSCRIPT, die belangrijk lijken te zijn voor de richting van dit sturingsproces. Er moet nader onderzocht worden hoe deze eiwitten precies werken en door welke genen ze worden geactiveerd. Vervolgens wil Adema kijken hoe de eiwitten gemanipuleerd kunnen worden zodanig dat de dendritische cellen het immuunsysteem een bepaalde richting opsturen. Prof. Dr.Carl Figdor en twee post-doc onderzoekers van dezelfde afdeling kregen eveneens beurzen van NWO. Hiermee wordt onder andere de in vivo techniek voor het ontwikkelen van DC vaccins verder ontwikkeld.
Het artikel is gepubliceerd in Conceptuur 46, maart 2006.
